aus derStandard.at, 14. Juli 2017, 18:37
Bis
vor kurzem galt es als undenkbar, erworbene Eigenschaften
weiterzuvererben. Eine neue Studie dokumentiert nun ganz konkret, wie
das passiert
Anders als die fixierten Buchstaben der DNA können sich diese epigenetischen Markierungen während unseres Lebens – etwa in Reaktion auf unsere Umwelt oder unseren Lebensstil – verändern. Mit anderen Worten: Stress, Krankheit oder die Ernährung wirken sich auf das epigenetische Gedächtnis der Zellen aus.
Unüberwindliche Barriere?
In den Lebenswissenschaften war man im 20. Jahrhundert überzeugt, dass solche epigenetischen Veränderungen nicht vererbt werden können: Sie würden bei der Entwicklung von Spermien und Eizellen völlig gelöscht. Das entsprechende Konzept dazu hat der deutsche Biologe August Weismann bereits 1883 formuliert: in Gestalt der nach ihm benannten, unüberwindlichen Barriere zwischen Körper- und Keimzellen.
Doch in den letzten Jahren mehrten sich Hinweise, dass epigenetische Markierungen tatsächlich an folgende Generationen weitervererbt werden und sich nicht an die Weismann-Barriere halten. So etwa zeigten neuere epidemiologische Studien eine Korrelation zwischen der Ernährung von Großvätern und einem erhöhten Risiko für Diabetes und Herz-Kreislauf-Erkrankungen bei deren Enkeln.
Wie das genau passiert, blieb bisher aber weitgehend unklar. Ein Team um Nicola Iovino (Max-Planck-Institut für Immunbiologie und Epigenetik) hat nun in einer neuen Studie im Fachblatt Science etwas mehr Licht in die Frage gebracht, wie epigenetische Veränderungen von der Mutter auf den Embryo übertragen werden.
Lebenswichtige epigenetische Instruktionen
Die Studie wurde zwar an Fruchtfliegen durchgeführt, man konzentrierte sich dabei aber auf eine epigenetische Modifikation namens H3K27me3, die es auch beim Menschen gibt. H3K27me3 wirkt auf die Verpackung der DNA im Zellkern ein und damit auch auf das Stilllegen bestimmter Gene. Wie Iovino und seine Kollegen herausfanden, sind die H3K27me3-Modifikationen in den Eizellen der Mutter auch noch nach der Befruchtung im Embryo vorhanden.
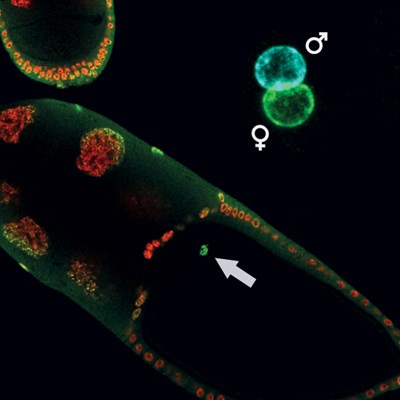
Eikammer
eines Fruchtfliegen-Weibchens mit der Eizelle, in der H3K27me3 durch
eine grüne Anfärbung sichtbar gemacht wurde. Diese Zelle wird gemeinsam
mit den Spermium zur Entstehung der nächsten Fliegengeneration
beitragen. In der oberen rechte Ecke sind ein mütterlicher und
väterlichen Vorkern vor ihrer Fusion während der Befruchtung abgebildet.
Die grüne Färbung von H3K27me3 erscheint ausschließlich im mütterlichen
Vorkern, was darauf hinweist, dass ihre epigenetischen Instruktionen in
die nächste Generation vererbt werden.
Damit ließen es die Forscher aber nicht bewenden: Sie wollten zudem noch wissen, ob die epigenetischen Modifikationen auch Funktionen in der Embryonalentwicklung erfüllen. Tatsächlich zeigte sich, dass diese vererbten epigenetischen Instruktionen einen genau abgestimmten Mechanismus darstellen, um die Genaktivierung während des Prozesses der frühen Embryonalentwicklung zu regulieren.
Wir (ver-)erben eben nicht nur Gene
Damit zeigt die Studie erstmals ganz handfest, dass wir von unseren Eltern nicht nur Gene, sondern auch epigenetische Mechanismen erben, welche die Aktivität unseres Erbguts steuern. "Es ist somit durchaus denkbar", so Iovino, "dass zumindest in einigen Fällen erworbene Umweltanpassungen über die Keimbahn auch an die Nachkommen weitergegeben werden könnten." (tasch)
maxplancksociety
Keine Kommentare:
Kommentar veröffentlichen