Wie die neuronale Vielfalt entsteht
Alle Neuronen unseres Gehirns gehen im Laufe der embryonalen Entwicklung aus sogenannten Stamm- oder Vorläuferzellen hervor. Bei diesem Prozess entsteht eine erstaunliche Vielfalt von Zelltypen: Allein im cerebralen Cortex sitzen einige Dutzend unterschiedliche Arten von Neuronen. Zusammen bilden sie unzählige neuronale Schaltkreise, die die Basis für unsere Wahrnehmung, unsere Gedanken und Taten bilden.
Rätselhaft blieb bisher allerdings, wie sich dieses einzigartige Gefüge entwickeln kann: Wie schaffen es die Vorläuferzellen, zur richtigen Zeit und am richtigen Ort ganz bestimmte Neuronen-Typen zu generieren? Genau dieser Frage haben sich nun Ludovic Telley von der Universität Genf und seine Kollegen gewidmet. Um herauszufinden, welche Faktoren die Zellproduktion steuern, schauten sie sich die Neurogenese bei Mäuse-Embryonen an.
Unterschiedliche Genprogramme
Konkret beobachteten sie im Detail, was im Laufe der Entwicklung des cerebralen Cortex bei den Nagern passiert. Möglich wurde dies durch eine neuartige, als FlashTag bezeichnete Technik, mit der Vorläuferzellen und die aus ihnen hervorgehenden Tochterzellen markiert und beobachtet werden können. Dabei untersuchten die Wissenschaftler auch, welche Gene in den Zellen zu unterschiedlichen Zeitpunkten in der Entwicklung abgelesen werden.
Die Auswertungen enthüllten: Die neokortikalen Stammzellen durchlaufen offenbar unterschiedliche Stadien, in denen sie jeweils andere Typen von Neuronen bilden. In jedem Stadium wird in der Zelle ein anderes genetisches Programm abgespult, wie Telley und sein Team berichten. Diese veränderte Genexpression wirkt sich auf die Merkmale der Tochterzellen aus – und damit auf die Neuronenart, die entsteht.
Interessanterweise werden die Vorläuferzellen dabei im Laufe der Zeit immer empfänglicher für Einflüsse aus der Umwelt. So sind die später aktivierten Genprogramme zunehmend auch von externen Signalen abhängig. Auch von der Neurogenese bei Erwachsenen ist bekannt, dass sie sowohl von genetischen Informationen als auch durch äußere Faktoren beeinflusst wird.
Weitere Untersuchungen zeigten, dass für die zeitgerechte Aktivierung der einzelnen Programme in der Zelle ein bestimmter Proteinkomplex von entscheidender Bedeutung ist: der sogenannte PRC2-Komplex. Dieser Komplex wird in den frühen Stammzellstadien besonders stark exprimiert, in den späteren dagegen nicht. Welchen Einfluss hat er?
Eingriff mit dramatischen Folgen
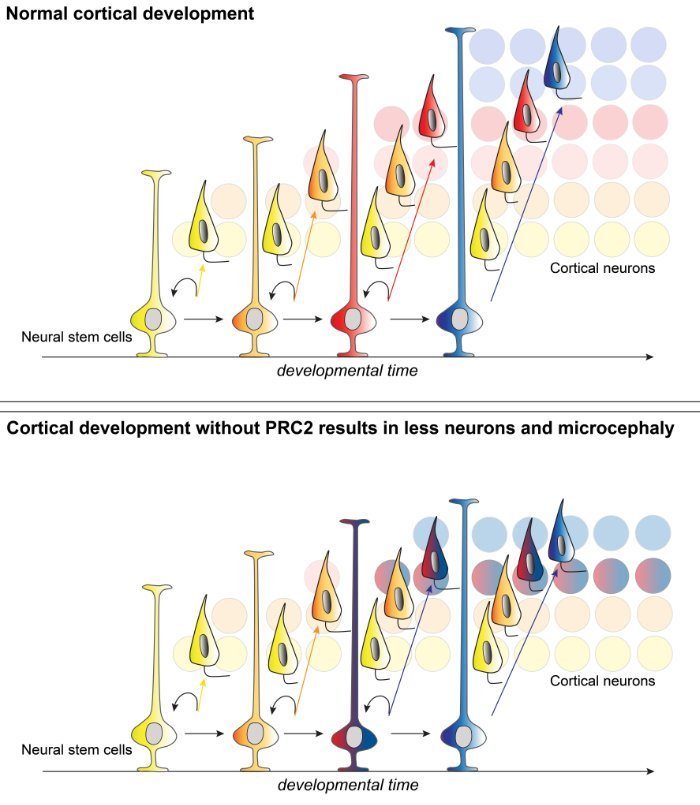
Dies überprüften die Forscher, indem sie sämtliche PRC2-Aktivitäten in den kortikalen Vorläuferzellen unterdrückten. Das Ergebnis war dramatisch. Die Stammzellen folgten nicht mehr ihrem natürlichen Entwicklungsweg. Sie durchliefen ihre unterschiedlichen Reifestadien viel schneller als normalerweise und produzierten so die falschen Neuronen zur falschen Zeit. Fast noch gravierender aber: Auch die Zahl der insgesamt produzierten Neuronen sank durch diesen Eingriff deutlich.
Betroffene Mäuse hatten daher nicht nur einen Cortex mit der falschen Zusammensetzung von Zellen. Ihr Gehirn war als Folge zudem deutlich kleiner. „Dies zeigt, wie empfindlich der Prozess der Gehirnentwicklung ist“, konstatiert Mitautorin Nicole Amberg vom Institute of Science and Technology Austria in Klosterneuburg. „Wir haben nun eine klarere Vorstellung davon, wie neurale Stammzellen im Laufe der kortikalen Entwicklung die richtige Art und Anzahl von Neuronen bilden.“
Fehlentwicklungen im Blick
In Zukunft erhoffen sich die Wissenschaftler von ihren Erkenntnissen auch ein besseres Verständnis der menschlichen Gehirnentwicklung und der Fehler, die dabei passieren können. Welche Mechanismen sind für Fehlentwicklungen des Gehirns und damit möglicherweise für die Entstehung von Erkrankungen wie Schizophrenie oder Autismus verantwortlich?
Zusätzlich könnten mithilfe der Studie „molekulare Rezepte“ für die Produktion bestimmter Zelltypen identifiziert werden, wie das Team betont. Vielleicht lassen sich so aus den Stammzellen von Patienten eines Tages gezielt ganz bestimmte Neuronen generieren. (Science, 2019; doi: 10.1126/science.aav2522)
Quelle: AAAS/ Universität Genf/ IST Austria
Keine Kommentare:
Kommentar veröffentlichen